1 Oksidacijos laipsnis
2 Valentingumas
3 Jonų atpažinimo reakcijos
4 Dujų nustatymas
5 Organinių medžiagų nustatymas
6 Kai kurios cheminės medžiagos
Oksidacijos laipsnis tai krūvis, kurį įgytų atomas, jei visos cheminį ryšį sudarančios elektronų poros būtų atiduotos elektroneigiamesniam elementui. Oksidacijos laipsnis užrašomas virš elemento simbolio su + arba ženklu: Mn+7(KMnO4). Jono krūvis žymimas taip: Ba2+. Oksidacijos laipsnio skaičiavimo taisyklės:
![]()
![]()
+1+x+4(2)=0; x=+7; x+4(2)=2; x=+6;
Oksidacijos laipsnis gali būti ir trupmeninis:
![]() (magnetitas)
Fe oksidacijos laipsnis yra
(magnetitas)
Fe oksidacijos laipsnis yra![]() .
.
Atsižvelgiant į oksidacijos
laipsnį, klasifikuojamos medžiagos, oksidacijosredukcijos reakcijos. Pavyzdžiui,
meta, orto, piro fosforo rūgštyse (atitinkamai ![]() ) fosforo
oksidacijos laipsnis yra +5. Vadinasi, šių rūgščių savybės panašios, bet jos
skiriasi nuo ortofosfitinės
) fosforo
oksidacijos laipsnis yra +5. Vadinasi, šių rūgščių savybės panašios, bet jos
skiriasi nuo ortofosfitinės ![]() rūgšties
savybių (P oksidacijos laipsnis yra +3).
rūgšties
savybių (P oksidacijos laipsnis yra +3).
Oksidacijos laipsnis leidžia numatyti medžiagų oksidacinesredukcines savybes. Aukščiausią oksidacijos laipsnį (kuris dažniausiai atitinka grupės numerį periodinėje elementų sistemoje) turintys elemento atomai reakcijose būna oksidatoriai. Atomai, turintys minimalų oksidacijos laipsnį, yra reduktoriai. Atomai, turintys tarpinį oksidacijos laipsnį, turi oksidacinių ir redukcinių savybių.
Perioduose iš kairės į dešinę oksidacijos laipsnis nuosekliai didėja, nes jis paprastai prilygsta grupės numeriui. Pagrindiniuose pogrupiuose iš viršaus į apačią žemesnio oksidacijos laipsnio junginių stabilumas didėja, o šalutiniuose atvirkščiai, pastovesni aukštesnio oksidacijos laipsnio junginiai.
Anksčiau valentingumą apibūdindavo kaip vieno atomo savybę prijungti tam tikrą kitų elementų skaičių. Vėliau valentingumas buvo susietas su nesuporuotų elektronų, sudarančių tarp atomų jungtis, skaičiumi. Pavyzdžiui:
H(1s1) valentingumas yra 1, He(1s2) valentingumas yra 0, Be(1s22s2) valentingumas yra 2 (nes vienas 2s elektronas pereina į sužadintą 2p orbitalę Be*1s22s12p1).
Valentingumas lygus elektronų porų, jungiančių tą atomą su kitų elementų atomais, skaičiui.
Dažnai atomo valentingumas junginyje lygus periodinės sistemos grupės, kurioje yra elementas, numeriui. Tačiau antrojo periodo elementų valentingumas ne visuomet sutampa su grupės numeriu ir nebūna didesnis nei 4.
Sudėtingose molekulėse
nustatyti valentingumą sunku, todėl dažnai vartojama oksidacijos
laipsnio savoka. Tai formalus ir lengviau apskaičiuojamas dydis.
| Nustatomasis jonas |
Reakcijos pavyzdys |
Reakcijos rezultatas |
| H+ | indikatoriai | mėlynas lakmuso popierėlis raudonuoja |
| Cu2+ |
CuCl2
+ 2NaOH ® Cu(OH)2 + 2NaCl CuCl2 + H2S ® CuS + 2HCl |
mėlynos spalvos
nuosėdos juodos spalvos nuosėdos |
| Fe2+ |
FeCl2
+ 2NaOH ® Fe(OH)2 + 2NaCl
3FeCl2
+ 2K3[Fe(CN)6] ® 3Fe2+
+ 2[Fe(CN)6]3 |
žalsvos spalvos, ore
ruduojančios nuosėdos: 4Fe(OH)2+O2+2H2O® ® 4Fe(OH)3 Jei tirpalai praskiesti, tai mėlynos spalvos nuosėdos nesusidaro, bet gaunami mėlynos spalvos tirpalai |
| Fe3+ |
FeCl3+
3NaOH ® Fe(OH)3 + 3NaCl
4FeCl3
+ 3K4[Fe(CN)6] ® 4Fe3+
+ 3[Fe(CN)6]4 FeCl3
+ 3KSCN ® |
rudos spalvos nuosėdos
Jei tirpalai praskiesti, tai mėlynos spalvos nuosėdos nesusidaro, bet gaunami mėlynos spalvos tirpalai Kraujo spalvos tirpalas |
| Al3+ |
AlCl3+
3NaOH ® Al(OH)3 + 3NaCl |
baltosspalvos
nuosėdos,tirpstančios šarmų pertekliuje:
Al(OH)3
+ NaOH®
|
|
|
NH4Cl
+ NaOH ® NH4OH +
NaCl NH4OH ® NH3 + H2O |
amoniako kvapas;
drėgnas raudonas lakmuso popierėlis mėlynuoja: NH3 + H2O ® NH4OH |
| Ba2+ |
BaCl2
+ Na2SO4 ® BaSO4 + 2NaCl |
baltos spalvos nuosėdos |
|
|
|
dažo liepsną gelsvai žalia spalva |
| Ca2+ |
CaCl2
+ Na2CO3 ® CaCO3 + 2NaCl |
baltos spalvos nuosėdos |
|
|
|
dažo liepsną plytos raudonumo spalva |
| Na+ |
|
dažo liepsną geltona spalva |
| K+ |
|
dažo liepsną violetine spalva |
| Zn2+ |
ZnCl2+
2NaOH ® Zn(OH)2 + 2NaCl |
baltos spalvos
nuosėdos, tirpstančios šarmų pertekliuje: Zn(OH)2
+ NaOH®
Na[Zn(OH)3] |
| Cl- |
NaCl
+ AgNO3 ® AgCl + NaNO3
2NaCl* +
H2SO4 ® |
baltos spalvos
nuosėdos išsiskiria bespalvės aštraus kvapo dujos |
| Br- |
AgNO3
+ KBr ® AgBr + KNO3 NaBr* ir H2SO4 |
šviesiai gelsvos
spalvos nuosėdos išsiskiria SO2 ir Br2 (rudos spalvos) dujos |
| I- |
AgNO3
+ KI ® AgI + KNO3
NaI* ir H2SO4 |
geltonos spalvos
nuosėdos išsiskiria SO2 ir I2 (violetinės spalvos) dujos |
| CH3COO- |
2NaCH3COO
+ H2SO4 ® 2CH3COOH + Na2SO4 |
silpnas acto rūgšties kvapas |
| OH- | indikatoriai | raudonas lakmuso popierėlis mėlynuoja |
|
|
8FeSO4+3H2SO4(konc.)+2HNO3 ® 3Fe2(SO4)3+ 2FeSO4NO+4H2O |
Jei tiriamame tirpalo laše yra nitratų, aplink FeSO4 kristaliuką susidaro rudas FeSO4NO junginio žiedas |
|
|
BaCl2 + Na2SO4 ® BaSO4 + 2NaCl | baltos spalvos nuosėdos, kuriosnetirpstadruskos rūgštyje HCl |
|
|
BaCl2
+ Na2SO3 ® BaSO3 + 2NaCl |
baltos spalvos nuosėdos, tirpstančios druskos rūgštyje HCl |
| S2- |
Na2S
+ Pb(CH3COO)2 ® PbS + 2NaCH3COO |
juodos spalvos nuosėdos |
|
|
K2CO3
+ 2HCl ®
2KCl + CO2 + H2O |
išsiskiria
bekvapės dujos, drumsčiančios kalkių vandenį: CO2
+ Ca(OH)2
® CaCO3 + H2O |
|
|
K3PO4
+3AgNO3 ® 3KNO3 + Ag3PO4 |
geltonos spalvos nuosėdos |
* Sieros rūgštimi nustatant halogenidus, šie analizei imami kietos druskos pavidalu
|
Dujos |
Reakcijos pavyzdys |
Reakcijos rezultatas |
| CO2 | CO2 + Ca(OH)2 ® CaCO3 + H2O | bekvapės dujos drumsčia kalkių vandenį. Iškrenta baltos spalvos nuosėdos |
| H2 |
|
įdėjus degančią skalelę į mėgintuvėlį su dujomis, liepsna užsidega pliuptelėdama |
| O2 |
2H2O2 |
rusenanti skalelė užsidega |
5. ORGANINIŲ MEDŽIAGŲ NUSTATYMAS
| Organinis junginys |
Reakcijos pavyzdys |
Reakcijos rezultatas |
|
Alkanai CnH2n+ 2 |
CnH2n+
2 + Br2(sk.)
® “ |
neblukina bromo vandens tirpalą |
|
Alkenai CnH2n |
CH3CH=CHCH3+Br2(s.k.)
® CH3CHCHCH3(sk.) | | Br Br CH2=CH2+[O]
+H2O ® | | OH OH |
blukina bromo vandens
tirpalą
violetinis kalio permanganato tirpalas pasidaro rudas, nes įvykus reakcijai susidaro MnO2 |
|
Alkinai CnH2n - 2 |
CH3
Cº
CCH3+Br2(sk.) ® CH3C=CCH3 | | Br Br CH3
C=CCH3+Br2(sk.) Br Br ® CH3CBr2=CBr2CH3 |
labai smarkiai blukina bromo vandens tirpalą |
| Aromatiniai angliavandeniliai |
C6H6+Br2(sk.)
® “
C6H6+Br2
|
neblukina bromo
vandens tirpalą išsiskyrusios dujos HBr reaguoja: AgNO3+HBr® AgBr +KNO3 iškrenta šviesiai gelsvos spalvos nuosėdos |
| Vienhidroksiliai alkoholiai |
C2H5OH+CuO
®
O ½ ½ CH3CH+Cu +H2O |
įdėjus įkaitintą vario vielą į mėgintuvėlį su etilo alkoholiu, atsiranda aštrus acto rūgšties kvapas ir nuo vario vielos dingsta juodos apnašos |
| Daugiahidroksiliai alkoholiai |
CH2OH
| +Cu(OH)2
® CH2O ® | Cu+2H2O |
mėlynos spalvos tirpalas |
| Fenolis |
6C6H5OH+FeCl3
® 3HCl+H3[Fe(OC6H5)] C6H5OH+3Br2(sk) ® 3HBr+C6H5(OH)Br3 |
susidaro violetinės
spalvos tirpalas baltos spalvos nuosėdos |
| Aldehidai |
O ½ ½ R--C-----H
+ Ag2O O ½ ½ R--C-----H+
RCOOH+2CuOH +H2O 2CuOH |
sidabrinio veidrodžio
reakcija šildomo mėgintuvėlio sienelės apsitraukia blizgančia kaip
veidrodis danga
šildant mišinį, mėlynos Cu(OH)2 nuosėdos iš pradžių pasidaro geltonos (CuOH), o po to raudonos (Cu2O) spalvos
|
| Karboninės rūgštys | CH3COOH+NaHCO3® NaCH3COO+CO2 +H2O | skiriasi dujos, kurios drumsčia kalkių vandenį: CO2 +Ca(OH)2® H2O+CaCO3 |
| Aminai (anilinas) |
C6H5NH2+3Br2(sk)
® 3HBr+C6H2(NH2)Br3 C6H5NH2+chlorkalkės ® |
baltos spalvos
nuosėdos violetinės spalvos tirpalas |
|
Angliavandeniai (gliukozė) |
CH2OH--(CHOH)4--COH +Ag2O t,amoniak.tirp CH2OH--(CHOH)4--COOH CH2OH--(CHOH)4--COH+ C6H7O(OH)3O2Cu+2H2O CH2OH--(CHOH)4--COH+ 2CuOH |
sidabrinio veidrodžio
reakcija šildomo mėgintuvėlio sienelės apsitraukia blizgančia kaip
veidrodis danga susidaro mėlynos spalvos tirpalas šildant mišinį, mėlynos Cu(OH)2 nuosėdos iš pradžių pasidaro geltonos (CuOH), o po to raudonos (Cu2O) spalvos |
6. KAI KURIOS CHEMINĖS MEDŽIAGOS
HCl druskos rūgštis. Vandeninis vandenilio chlorido tirpalas vandenyje. Koncentruota yra 37% (d = 1,19 g/ml).
H2SO4 sieros rūgštis. Koncentruota yra 95,98% (d = 1,84g/ml). Tirpsta vandenyje, išskirdama didelį šilumos kiekį. Gaminama Kėdainių chemijos gamykloje.
HNO3 azoto rūgštis. Aštraus kvapo bespalvis skystis, gerai tirpsta vandenyje. Koncentruota yra 60% (d = 1,367 g/ml), rudos spalvos dėl NO2 priemaišų. Šviesoje skyla. Gaminama Jonavoje.
Karališkas vanduo (aqua regia) koncentruotų rūgščių mišinys: 1 tūris HNO3 ir 3 tūriai HCl. Stiprus oksidatorius, tirpina Pt, Au ir kitus metalus, netirpstančius paprastose rūgštyse.
H3PO4 ortofosfatinė rūgštis. Kieta kristalinė medžiaga, gerai tirpstanti vandenyje. Gaminama Kėdainių chemijos gamykloje.
CH3COOH acto rūgštis.
NaOH muilo akmuo arba kaustinė soda. Kieta balta kristalinė medžiaga. Gerai tirpsta vandenyje, išskirdama šilumą. Ore ištyžta, nes sugeria drėgmę.
CuSO4 × 5H2O mėlynasis akmenėlis.
FeSO4 × 7H2O žaliasis akmenėlis.
CaSO4 × 2H2O gipsas.
CaO negesintos kalkės.
Ca(OH)2 kalcio hidroksidas (gesintos kalkės). Balti birūs milteliai, menkai tirpstantys vandenyje.
NaCl valgomoji druska.
Soda:
Potašas K2CO3, naudojamas kepimui;
Krakmolas (C6H10O5)n, polisacharidas.
C2H5OH etilo alkoholis (etanolis, vyno spiritas). Bespalvis skystis, bet kokiu santykiu maišosi su vandeniu, alkoholiais, gliceroliu ir kitais tirpikliais. Dega melsva liepsna. Naudojamas gaminant sintetinį kaučiuką, chloroformą ir kt. Etilo alkoholis narkotikas.
Nitroglicerinas glicerolio ir azoto rūgšties esteris. Aliejiškas skystis, netirpstantis vandenyje. Sprogsta pašildytas ar sukrėstas. Naudojamas dinamitui gaminti. 1% alkoholinis nitroglicerino tirpalas naudojamas medicinoje kraujagyslėms praplėsti. Nitroglicerino formulė:
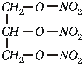
Cukringosios medžiagos
Sacharozė (C12H22O11) runkelių, cukranendrių cukrus. Molekulę sudaro gliukozės ir fruktozės liekanos. Bespalviai daugiasieniai kristaliukai, gerai tirpstantys vandenyje. Sacharozė yra cukrinio diabeto ir dantų karieso priežastis.
Sacharinas 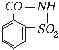 .
Pirmą kartą susintetintas 1879 m. Jis yra 400500 kartų saldesnis už cukrų, bet
truputį kartina. Nekaloringa medžiaga, kurią žmogaus organizmas gerai pašalina.
Patariama naudoti nedidelėmis dozėmis.
.
Pirmą kartą susintetintas 1879 m. Jis yra 400500 kartų saldesnis už cukrų, bet
truputį kartina. Nekaloringa medžiaga, kurią žmogaus organizmas gerai pašalina.
Patariama naudoti nedidelėmis dozėmis.
Geriausias dirbtinis cukraus pakaitalas sorbitolis:
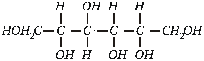
Tai dvigubai mažiau saldesnė nei cukrus medžiaga, tačiau nepadidina cukraus kiekio kraujyje. Naudoja diabetikai.
Ksilitolis
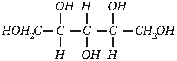 , gaunamas iš
daugelio augalų. Jis du kartus saldesnis už cukrų, sumažina dantų karieso
procesą. Pigesnis nei sorbitolis, bet 10 kartų brangesnis už cukrų.
, gaunamas iš
daugelio augalų. Jis du kartus saldesnis už cukrų, sumažina dantų karieso
procesą. Pigesnis nei sorbitolis, bet 10 kartų brangesnis už cukrų.
Geltonasis cukrus tai neišgrynintas cukrus, tarpinis cukraus gamybos produktas.
Karčioji druska MgSO4 × 7H2O. Vartojamas kaip vaistas prieš vidurių užkietėjimą.
KMnO4 kalio permanganatas (antiseptikas).
Sidabro vanduo vanduo, kuriame ištirpęs didelis Ag kiekis. Šiame vandenyje esantys Ag+ jonai pasižymi antiseptinėmis savybėmis.
Skystas stiklas (kanceliariniai klijai) Na2SiO3.
Amoniako vanduo NH3 × H2O. Gaunamas prisotinant vandenį amoniako dujomis. 1l vandens tirpsta 700ml amoniako dujų.
Askorbino
rūgštis (vitaminas C): 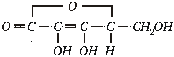 . Bespalvė
kristalinė medžiaga.
. Bespalvė
kristalinė medžiaga.
Polimetilmetakrilatas (organinis
stiklas): 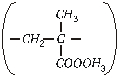 .
.
Plastilinas medžiaga lipdymui. Tai molis su vaško, taukų ir vazelino priemaišomis, neleidžiančiomis jam išdžiūti.
Freonai (šaldikliai) gaunami veikiant fluoro vandeniliu atitinkamus chlorintus angliavandenilius. Nenuodingi. Labiausiai paplitęs freonas12 (CCl2F2) ir freonas11 (CCl3F). Vartojami buitiniuose šaldytuvuose.